Fue diseñado por
el químico alemán J. Wener,
en base a la ley de Moseley y la distribución
electrónica de los elementos. Además tomo como referencia la Tabla de
Mendeleev.
DESCRIPCION GENERAL:
1. Los 109 elementos reconocidos por la Unión Internacional de Química Pura y Aplicada (IUPAC) están ordenados según el numero atomico creciente, en 7 periodos y 16 grupos (8 grupos A y 8 grupos B). Siendo el primer elemento Hidrogeno (Z = 1) y el último reconocido hasta el momento meitnerio (Z = 109); pero se tienen sintetizados hasta el elemento 118.
2. Periodo, es el ordenamiento de los
elementos en línea horizontal. Estos elementos difieren en propiedades, pero
tienen la misma cantidad de niveles en su estructura atómica
·
Cada periodo (excepto el primero) comienza con un metal alcalino y
termina con un gas noble.
·
El séptimo periodo esta incompleto.
·
El sexto periodo es el que posee mayor cantidad de elementos (es el
periodo mas largo)
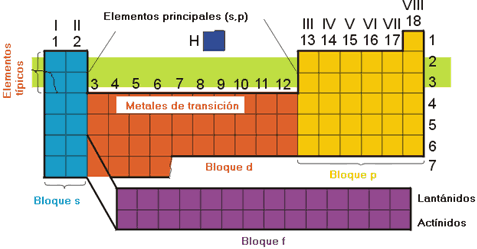
3. Grupo o Familia, Es el
ordenamiento de los elementos en columna. Estos elementos presentan similar
disposición de sus electrones externos; de allí que forman familias de
elementos con propiedades químicas similares.
Grupos “A”
Están formados por
los elementos representativos donde
los electrones externos o electrones de valencia estan en orbitales “s” y/o
“p”; por lo tanto sus propiedades dependen de estos orbitales.
Las propiedades de los
elementos representativos dentro del grupo o familia varían de manera muy
regular, a ello se debe el nombre de elemento representativo.
Grupos “B”
Están formados por elementos
de transición, en cuyos átomos el electrón de mayor energía relativa están
en orbitales “d” o “f”; y sus electrones de valencia se encuentran en orbitales
“s” (del último nivel) y/o orbitales “d” o “f”; por lo tanto sus propiedades
químicas dependen de estos orbitales.
Se denominan elementos
de transición, porque se consideran como tránsito entre elementos metálicos
de alta reactividad que forman generalmente bases fuertes (IA y IIA) y los
elementos de menor carácter metálico que poseen más acentuado su tendencia a
formar ácidos (IIIA, IVA, … VIIA).
El
grupo VIIIB abarca tres columnas (familia del Fe, Co y Ni). Los elementos del
grupo IB (Cu, Ag, Au), así como también los elementos del grupo VIB (Cr y Mo)
no cumplen la distribución electrónica, como ya se analizará oportunamente.
Los
elementos del mismo grupo generalmente difieren en sus propiedades. Los
elementos de transición interna (tierras raras), poseen electrones de mayor
energía relativa en orbitales “f” y pertenecen al grupo IIIB; a estos se les
denomina lantánidos y actínidos, cuya abundancia en la naturaleza es muy escasa
y muchas veces solo se encuentran en forma de trazas combinados con otros
elementos, razón por lo cual se llama “tierras raras”.
Lantánidos (lantanoides): comienza con lantano (Z=57) y termina en
lutecio (Z=71), poseen propiedades semejantes al lantano.
Actínidos (actinoides): comienza con el actinio (Z=87) y termina
con lawrencio (Z=103), poseen propiedades semejantes al actinio
Este comentario ha sido eliminado por el autor.
ResponderEliminarLa neta
Eliminarcual es la fuente bibliográfica?
ResponderEliminarcual es la fuente?
ResponderEliminarla encontraste?
Eliminarno
Eliminarhttp://student.mohammed.mx/tutoriales/quimica/t31.htm
Eliminarhttp://student.mohammed.mx/tutoriales/quimica/t31.htm
ResponderEliminargod
ResponderEliminargenial :D
EliminarGRANDEE HEROE SIN CAPA!!
ResponderEliminarCuál es el nombre de la página ?? Quien la realizó?? Y el año en que se publicó??
ResponderEliminarno te pases de vrg es un ching pero me sirve gracias, alivianese o lo orino
ResponderEliminar